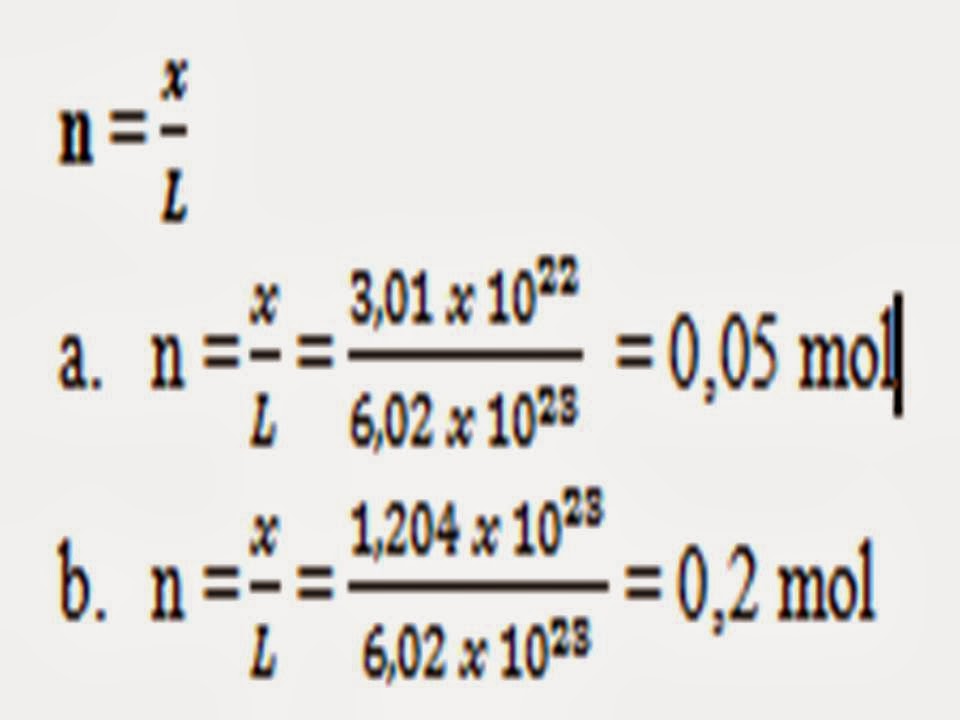KONSEP MOL
KD 1 : Menjelaskan konsep mol
Tujuan :
Menjelaskan pengertian mol yang
dijelaskan sebagai satuan jumlah partikel zat.
Menjelaskan arti massa atom relatif
(Ar) dan massa molekul relatif (Mr).
Menentukan massa atom relatif dari
massa rata-rata dan kelimpahan isotop.
Menghitung massa molekul relatif
suatu senyawa.
Menjelaskan pengertian massa molar.
Menjelaskan volume molar gas pada STP
(00C dan 1 atmosfer).
Menghitung volume sejumlah massa gas
pada suhu dan tekanan tertentu.
Menghitung jumlah mol yang
dikonversikan dengan jumlah partikel, massa dan volume zat.
MATERI :
A. Pengertian Mol
Mol (1896-
Wilhelm Ostwald) adalah jumlah zat yang mengandung partikel zat itu sebanyak
atom/molekul/ion yang terdapat dalam 12 gram C-12
1 mol = 6,02 x 1023. Bilangan 6,02 x 1023 ini
disebut tetapan avogadro dan
dinyatakan dengan lambang L.
B. Hubungan Jumlah Mol dengan Jumlah Partikel
JP = n x 6,02 x 1023
Dimana : JP = jumlah partikel
n = jumlah mol
Contoh :
1.
Tentukan jumlah partikel (ion/ atom/molekul) yang terdapat dalam :
a.
1 mol Ca b. 2 mol H2O
Jawab : Gunakan rumus : JP = n x 6,02 x 1023
a.
JP = 1 mol x 6,02 x 1023 atom/mol = 6,02 x 1023 atom
b.
JP = 2 mol x 6,02 x 1023 molekul/mol = 12,05 x 1023
molekul
2.
Tentukan Jumlah mol dari :
a.
3,01 x 1022 atom besi b. 1,204 x 1023 molekul air
Jawab :
Rumus JP = n x 6,02 x 1023 dapat ditata ulang
untuk menghitung jumlah mol menjadi
C.
Hubungan Jumlah Mol dengan Massa
Molar ( Ar / Mr ) dan Massa
Telah diketahui bahwa satu mol adalah jumlah zat yang mangandung
partikel (atom, molekul, ion) sebanyak atom yang terdapat dalam 12 gram karbon
dengan nomor massa 12 (karbon-12,C-12). Sehingga terlihat bahwa massa 1 mol
C-12 adalah 12 gram. Massa 1 mol zat disebut massa molar. Massa molar sama
dengan massa molekul relatif (Mr) atau massa atom relatif (Ar) suatu zat yang dinyatakan
dalam gram.
1. Massa Atom Relatif (Ar)
Perbandingan massa satu atom dengan massa atom standar
disebut massa atom relatif (Ar). Karena atom sangat ringan, maka tidak dapat
digunakan satuan g dan kg untuk massa atom, maka digunakan satuan massa atom
(s. m. a). 1 s.m.a = 1,66 x 10-24 g
Saat ini penentuan massa atom relatif dan massa molekul
relatif dilakukan dengan menggunakan spektrometer massa . Dengan alat ini,
ternyata diketahui bahwa atom suatu unsur dapat memiliki massa yang
berbeda-beda (disebut isotop). Pertama kali spektrometer massa dikembangkan
oleh ahli fisika dari Inggris F. W. Aston pada tahun 1920.
Misalnya, untuk suatu unsur mempunyai dua macam isotop,
berlaku rumus:
Hubungan jumlah mol, massa dan massa
molar dapat ditulis sebagai berikut :
m =
n x mm ,
dimana : m = massa; n =jumlah mol; dan mm
= Ar atau Mr
Contoh
:
1. Hitunglah
massa dari :
a. 2
mol atom magnesium
b. 2
mol molekul magnesium hidroksida (Mg(OH)2)
(Ar H=1; Ar O=16; Ar Mg =24)
Jawab :
a. m =
n x Ar = 2 x Ar Mg = 2 x 24 = 48
gram
b. m =
n x Mr = 2 x Mr Mg(OH)2 = 2 x (Ar Mg
+ 2.Ar H + 2.Ar O)
= 2
x (24+2.1+2.16) = 2 x 58 = 116 gram
D. Hubungan Jumlah mol (n) dengan Volume molar gas (Vm)
V = n x Vm, dimana:
V = Volume gas
n =
jumlah mol
Vm = volume molar
Adapun volume molar pada berbagai
keadaan adalah sebagai berikut :
·
Pada suhu 0ºC, 1 atm, yang dikenal sebagai keadaan standart (STP), Vm =
22,4 L/mol
·
Pada suhu 25ºC, 1 atm, yang dikenal sebagai keadaan kamar (RTP), Vm = 24
L/mol
·
Pada suhu diluar STP & RTP, volume gas dapat ditentukan dengan
persamaan gas ideal :
Hubungan jumlah mol dengan jumlah
partikel, massa, volume dapat dirangkum sebagai berikut :
SOAL KONSEP MOL :
KD 1 : MENJELASKAN KONSEP MOL
(AYO KALIAN PASTI BISA.... J )
Diketahui : (Ar C=12, O=16, H=1, N=14, S =32,
Al=27, Fe =56,
Hg = 200)
1.
Hitunglah
a.
Jumlah
molekul dalam 15 mol Al !
b.
Massa dari
5 mol gas metana (CH4) !
c.
Volume dari
0,5 mol CO2 (keadaan STP)
d.
Massa dari
gas H2S yang memiliki 9,03 x 1021 atom
penyusun!
2.
Berapa gram
N terdapat dalam 0,5 mol NH3 !
3.
Berapa mol
Oksigen terdapat dalam 36 gram H2O !
Tentukan massa dari :
Tentukan massa dari :
a.
0,8 mol NH3
b.
1,204 x 1021 atom Hg
c. 5,6 liter CH4 (keadaan STP)
4.
Berapa mol
C yang terdapat dalam :
a.
85,5 gram C12H22O11
b. 6
gram CH3COOH
5.
Berapa gram
O yang terdapat dalam
a.
0,5 mol C6H12O6
b. 4
mol Besi(III) oksida Fe2O3
6.
Tentukan
Ar X bila diketahui 2,4 x 1023 atom X massanya 60 gram !
7. Neon terdiri atas 2 isotop yaitu 20Ne dan 22Ne
. Jika Ar Ne = 20,20 berapakah
kelimpahan / persentase
masing-masing isotop tersebut ?
J Tetap Semangat J